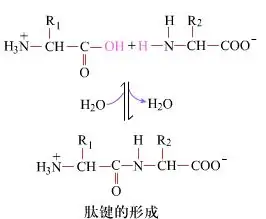
Auf der Oberfläche ist die Bildung von Peptidbindungen, die Dipeptide ergeben, ein einfacher chemischer Prozess. Dies bedeutet, dass die beiden Aminosäurekomponenten durch eine Peptidbindung verbunden sind, eine Amidbindung, während sie dehydriert werden.
Die Bildung von Peptidbindungen ist die Aktivierung einer Aminosäure unter milden Reaktionsbedingungen. (A) Carboxyleinheit, zweite Aminosäure (B) Die nukleophile aktivierte Carboxyleinheit bildet dann das Dipeptid (A-B). "Wenn die Carboxylkomponente (a) nicht geschützt ist, kann die Bildung der Peptidbindung nicht kontrolliert werden." Nebenprodukte wie lineare und zyklische Peptide können mit Zielverbindungen a-b gemischt werden. Daher müssen alle funktionellen Gruppen, die nicht an der Bildung von Peptidbindungen beteiligt sind, während der Peptidsynthese vorübergehend reversibel geschützt werden.
Die Peptidsynthese - die Bildung jeder Peptidbindung - umfasst also drei Schritte der Aggregation.
Der erste Schritt besteht darin, einige Aminosäuren herzustellen, die Schutz benötigen, und die zwitterionische Struktur von Aminosäuren existiert nicht mehr.
Der zweite Schritt ist eine zweistufige Reaktion zur Bildung von Peptidbindungen, bei der die Carboxylgruppe der N-geschützten Aminosäure zuerst zum aktiven Zwischenprodukt aktiviert wird und dann die Peptidbindung gebildet wird. Diese gekoppelte Reaktion kann entweder als einstufige Reaktion oder als zwei sequentielle Reaktionen auftreten.
Der dritte Schritt ist die selektive Entfernung oder vollständige Entfernung der Schutzbasis. Obwohl jede Entfernung erst nach Zusammenbau aller Peptidketten auftreten kann, ist auch eine selektive Entfernung von Schutzgruppen erforderlich, um die Peptidsynthese fortzusetzen.
Denn 10 Aminosäuren (Ser, Thr, Tyr, ASP, Glu, Lys, Arg, His, Sec und Cys) enthalten Seitenkettenfunktionsgruppen, die selektiven Schutz erfordern, wodurch die Peptidsynthese komplizierter wird. Temporäre und semi-permanente Schutzbasis müssen aufgrund der unterschiedlichen Selektivitätsanforderungen unterschieden werden. Temporäre Schutzgruppen werden im nächsten Schritt verwendet, um den temporären Schutz von Aminosäure- oder Carboxylfunktionsgruppen widerzuspiegeln. Semipermanente Schutzgruppen werden entfernt, ohne bereits gebildete Peptidbindungen oder Aminosäureseitenketten zu stören, manchmal während der Synthese.
"Idealerweise sollte die Aktivierung der Carboxylkomponente und die anschließende Bildung von Peptidbindungen (Kopplungsreaktionen) ohne racemische oder Nebenproduktbildung schnell sein, und molare Reaktanten sollten angewendet werden, um hohe Ausbeuten zu erzielen." Leider erfüllt keine der chemischen Kopplungsmethoden diese Anforderungen, und nur wenige sind für die praktische Synthese geeignet.
Während der Peptidsynthese sind die an verschiedenen Reaktionen beteiligten funktionellen Gruppen in der Regel mit dem manuellen Zentrum verbunden, wobei Glycin die einzige Ausnahme ist und ein potenzielles Drehrisiko besteht.
Der letzte Schritt im Peptidsynthesezyklus ist die Entfernung aller Schutzgruppen. Die selektive Entfernung von Schutzgruppen ist für die Peptidkettenerweiterung sowie die Erfordernis zur vollständigen Entfernung des Schutzes in der Dipeptid -Synthese wichtig. Synthetische Strategien sollten sorgfältig geplant werden. Abhängig von der strategischen Wahl kann N die α-Amino- oder Carboxylschutzgruppen selektiv entfernen. Der Begriff „Strategie“ bezieht sich auf die Abfolge der Kondensationsreaktionen einzelner Aminosäuren. Im Allgemeinen gibt es einen Unterschied zwischen allmählicher Synthese und Fragmentkondensation. Die Peptidsynthese (auch bekannt als „konventionelle Synthese“) findet in Lösung statt. In den meisten Fällen kann eine allmähliche Verlängerung der Peptidkette nur durch Verwendung der Peptidkette synthetisiert werden, um kürzere Fragmente zu synthetisieren. Um längere Peptide zu synthetisieren, müssen die Zielmoleküle in geeignete Fragmente unterteilt werden und feststellen, dass sie den Differenzierungsgrad am C -Terminus minimieren können. Nachdem die einzelnen Fragmente allmählich zusammengesetzt sind, wird die Zielverbindung zusammengeschlossen. Die Strategie der Peptidsynthese umfasst die Selektion des besten und am besten geeigneten Schutzfragments, und die Strategie der Peptidsynthese umfasst die Auswahl der am besten geeigneten Kombination von Schutzbasen und der besten Methode der Fragmentkonjugation.
Postzeit: 2025-07-02