Peptide sind eine Klasse von Verbindungen, die durch den Zusammenhang mehrerer Aminosäuren durch Peptidbindungen gebildet werden. Sie sind allgegenwärtig in lebenden Organismen. Bisher wurden in lebenden Organismen Zehntausende von Peptiden gefunden. Peptide spielen eine wichtige Rolle bei der Regulierung der funktionellen Aktivitäten verschiedener Systeme, Organe, Gewebe und Zellen und in Lebensaktivitäten und werden häufig in der Funktionsanalyse, der Antikörperforschung, der Arzneimittelentwicklung und anderer Bereiche verwendet. Mit der Entwicklung der Biotechnologie- und Peptidsynthese -Technologie wurden in der Klinik immer mehr Peptidmedikamente entwickelt und angewendet.
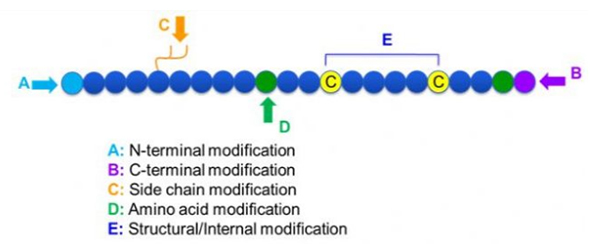
Es gibt eine Vielzahl von Peptidmodifikationen, die einfach in Post-Modifikation und Prozessmodifikation (unter Verwendung der abgeleiteten Aminosäuremodifikation) und der N-terminalen Modifikation, der C-terminalen Modifikation, der Modifikation der Seitenketten, der Modifikation von Aminosäure, der Modifikation von Skelett usw., abhängig von der Modifikationsstelle unterteilt werden können (Abbildung 1). Als wichtiges Mittel zur Veränderung der Hauptkettenstruktur oder der Seitenkettengruppen von Peptidketten kann die Peptidmodifikation die physikalischen und chemischen Eigenschaften von Peptidverbindungen wirksam verändern, die Wasserlöslichkeit verlängern, die Wirkungszeit in vivo verlängern, ihre biologische Verteilung verändern, die Eliminierung der Eliminierung der Immunogenität reduzieren, die toxischen Nebenwirkungen usw., in diesem Papier, mehrere Hauptpeptidmodifikationsstrategien und ihre Charakterien und ihre Eigenschaften sind die Charaktere, die die toxischen Nebenwirkungen usw. verändern.
1. Cyclisierung
Cyclische Peptide haben viele Anwendungen in Biomedizin, und viele natürliche Peptide mit biologischer Aktivität sind zyklische Peptide. Da zyklische Peptide tendenziell starrer sind als lineare Peptide, können sie extrem resistent gegen das Verdauungssystem sind, im Verdauungstrakt überleben und eine stärkere Affinität zu Zielrezeptoren aufweisen. Die Cyclisierung ist der direkteste Weg, um cyclische Peptide zu synthetisieren, insbesondere für Peptide mit großem Strukturskelett. Gemäß dem Cyclisierungsmodus kann es in die Seitenkettenkettentyp, den terminalen - Seitenkettentyp, den terminalen - terminalen Typ (End -to -End -Typ) unterteilt werden.
(1) Sidechain-to-Sidechain
Die häufigste Art der Seitenkette bis zur Seitenkettenzyklisierung ist die Überbrückung der Disulfid zwischen Cysteinresten. Diese Cyclisierung wird durch ein Paar von Cysteinresten eingeführt, die deprotiert und dann oxidiert werden, um Disulfidbindungen zu bilden. Die polyzyklische Synthese kann durch selektive Entfernung von Sulfhydrylschutzgruppen erreicht werden. Die Cyclisierung kann entweder in einem Lösungsmittel nach der Entbindung oder in einem Vordissoziationsharz erfolgen. Die Cyclisierung an Harzen kann weniger wirksam sein als Lösungsmittelcyklisierung, da die Peptide in Harzen nicht leicht zyklifizierte Konformationen bilden. Eine andere Art der Seitenkettenzyklisierung ist die Bildung einer Amidstruktur zwischen einem Asparaginsäure- oder Glutaminsäurerest und der Base -Aminosäure, die erfordert, dass die Gruppe der Seitenkettenschutz selektiv vom Polypeptid entweder am Harz oder nach der Dissoziation entfernt werden kann. Die dritte Art der Seitenkettenzyklisierung ist die Bildung von Diphenylether durch Tyrosin oder P-Hydroxyphenylglycin. Diese Art der Cyclisierung in Naturprodukten findet sich nur in mikrobiellen Produkten, und Cyclisierungsprodukte haben häufig einen potenziellen medizinischen Wert. Die Herstellung dieser Verbindungen erfordert einzigartige Reaktionsbedingungen, sodass sie nicht häufig bei der Synthese herkömmlicher Peptide verwendet werden.

(2) Terminal-to-Sidechain
Die terminalseitige Kettenzyklisierung beinhaltet normalerweise die C-terminale mit der Aminogruppe der Lysin- oder Ornithin-Seitenkette oder der N-terminalen mit der Asparaginsäure- oder Glutaminsäure-Seitenkette. Andere Polypeptidcyclisierung erfolgt durch die Bildung von Etherbindungen zwischen terminalen C- und Serin- oder Threonin -Seitenketten.
(3) Terminal- oder Kopf-an-Schwanz-Typ
Kettenpolypeptide können entweder in einem Lösungsmittel gefahren oder auf einem Harz an Seitenkettenzyklation fixiert werden. Bei der Lösungsmittelzentralisierung sollten niedrige Peptidekonzentrationen verwendet werden, um die Oligomerisierung von Peptiden zu vermeiden. Die Ausbeute eines Kopf-an-Schwanz-Synthetikrings-Polypeptids hängt von der Sequenz des Kettenpolypeptids ab. Daher sollte zuerst eine Bibliothek möglicher verketteter Bleipeptide erzeugt werden, gefolgt von der Cyclisierung, um die Sequenz mit den besten Ergebnissen zu finden.
2. N-Methylierung
Die N-Methylierung tritt ursprünglich in natürlichen Peptiden auf und wird in die Peptidsynthese eingeführt, um die Bildung von Wasserstoffbrückenbindungen zu verhindern, wodurch Peptide gegen biologischer Abbau und Clearance resistenter werden. Die Synthese von Peptiden unter Verwendung von n-methylierten Aminosäurerivaten ist die wichtigste Methode. Zusätzlich kann auch die Mitsunobu-Reaktion von N- (2-Nitrobenzol-Sulfonylchlorid) Polypeptid-Resin-Zwischenprodukten mit Methanol verwendet werden. Diese Methode wurde verwendet, um cyclische Peptidbibliotheken herzustellen, die n-methylierte Aminosäuren enthalten.
3. Phosphorylierung
Die Phosphorylierung ist eine der häufigsten posttranslationalen Modifikationen in der Natur. In menschlichen Zellen werden mehr als 30% der Proteine phosphoryliert. Die Phosphorylierung, insbesondere die reversible Phosphorylierung, spielt eine wichtige Rolle bei der Kontrolle vieler zellulärer Prozesse wie Signaltransduktion, Genexpression, Zellzyklus und Cytoskelettregulation und Apoptose.
Die Phosphorylierung kann an einer Vielzahl von Aminosäureresten beobachtet werden, aber die häufigsten Phosphorylierungsziele sind Serin-, Threonin- und Tyrosinreste. Phosphotyrosin-, Phosphothronin- und Phosphoserin -Derivate können während der Synthese entweder in Peptide eingeführt oder nach der Peptidsynthese gebildet werden. Die selektive Phosphorylierung kann unter Verwendung von Resten von Serin, Threonin und Tyrosin erreicht werden, die selektiv Schutzgruppen entfernen. Einige Phosphorylierungsreagenzien können auch Phosphorsäurgruppen durch Nachmodifikation in das Polypeptid einführen. In den letzten Jahren wurde die ortsspezifische Phosphorylierung von Lysin unter Verwendung einer chemisch selektiven Staudinger-Phosphit-Reaktion erreicht (Abbildung 3).

4. Myristoylierung und Palmitoylierung
Die Acylierung des N-terminalen mit Fettsäuren ermöglicht es Peptiden oder Proteinen, an Zellmembranen zu binden. Die myridamoylierte Sequenz auf dem N-terminalen ermöglicht es, Proteinkinasen der SRC-Familie und umgekehrte Transkriptase-GAQ-Proteine anzugehen, um an Zellmembranen zu binden. Myristische Säure wurde unter Verwendung von Standard-Kopplungsreaktionen mit der N-terminalen Harzpolypeptid mit Standardkupplungsreaktionen verbunden, und das resultierende Lipopeptid konnte unter Standardbedingungen dissoziiert und durch RP-HPLC gereinigt werden.
5. Glykosylierung
Glycopeptide wie Vancomycin und Teicolanin sind wichtige Antibiotika zur Behandlung von medikamentenresistenten bakteriellen Infektionen, und andere Glycopeptide werden häufig verwendet, um das Immunsystem zu stimulieren. Da viele mikrobielle Antigene glykosyliert sind, ist es außerdem von großer Bedeutung, Glykopeptide zur Verbesserung der therapeutischen Wirkung der Infektion zu untersuchen. Andererseits wurde festgestellt, dass die Proteine auf der Zellmembran von Tumorzellen eine abnormale Glykosylierung aufweisen, wodurch Glykopeptide eine wichtige Rolle bei der Krebs- und Tumor -Immunverteidigungsforschung spielen. Glycopeptide werden durch FMOC/T-Bu-Methode hergestellt. Glykosylierte Reste wie Threonin und Serin werden häufig durch Pentafluorphenolester -aktivierte FMOCs in Polypeptide eingeführt, um glykosylierte Aminosäuren zu schützen.
6. Isopren
Die Isopentadienylierung tritt an Cysteinresten in der Seitenkette in der Nähe des C-terminalen auf. Protein-Isopren kann die Zellmembranaffinität verbessern und eine Protein-Protein-Wechselwirkung bilden. Zu isopentadiente Proteinen gehören Tyrosinphosphatase, kleine GTase, Cochaperonmoleküle, Kernlamina und zentromere Bindungsproteine. Isoprenpolypeptide können unter Verwendung von Isopren an Harzen oder durch Einführung von Cysteinderivaten hergestellt werden.
7. Polyethylenglykol (PEG) -Modifikation
Die PEG -Modifikation kann verwendet werden, um die hydrolytische Stabilität, Bioverteilung und Peptidlöslichkeit der Protein zu verbessern. Die Einführung von PEG -Ketten in Peptide kann ihre pharmakologischen Eigenschaften verbessern und auch die Hydrolyse von Peptiden durch proteolytische Enzyme hemmen. PEG -Peptide gehen leichter durch den glomerulären Kapillarquerschnitt als gewöhnliche Peptide, was die Nieren -Clearance stark verringert. Aufgrund der ausgedehnten aktiven Halbwertszeit von PEG-Peptiden in vivo kann das normale Behandlungsniveau mit niedrigeren Dosen und weniger häufigen Peptidmedikamenten aufrechterhalten werden. Die PEG -Modifikation hat jedoch auch negative Auswirkungen. Große Mengen an PEG verhindern, dass das Enzym das Peptid abbaute und auch die Bindung des Peptids an den Zielrezeptor verringert. Die niedrige Affinität von PEG-Peptiden wird jedoch normalerweise durch ihre längere pharmakokinetische Halbwertszeit ausgeglichen. Durch längere Peptide sind PEG-Peptide eine größere Wahrscheinlichkeit, dass sie in Zielgewebe aufgenommen werden. Daher sollten PEG -Polymerspezifikationen für optimale Ergebnisse optimiert werden. Andererseits akkumulieren PEG -Peptide in der Leber aufgrund einer verringerten Nieren -Clearance, was zu einem makromolekularen Syndrom führt. Daher müssen PEG -Modifikationen sorgfältiger ausgelegt werden, wenn Peptide für Drogentests verwendet werden.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, N-Hydroxysuccinimid -nhs, Acryl-ch2ch2Cooh, Aldehyd-Cho (wie propional-alte, butyrald), Acrylbasi P -Toluenesulfonat -oots, Succinimid -Succinat -Ss usw. PEG -Derivate mit Carboxylsäuren können an N -terminale Amine oder Lysin -Seitenketten gekoppelt werden. Amino-aktivierte PEG kann mit Asparaginsäure- oder Glutaminsäure-Seitenketten gekoppelt werden. Malaktiviertes PEG kann an Mercaptan von vollständig decotedierten Cystein-Seitenketten konjugiert werden [11]. PEG-Modifikatoren werden üblicherweise wie folgt klassifiziert (Hinweis: MPEG ist Methoxy-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Stiftmodifikator mit gerader Kette
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-Butyrald, MPEG-SSS
(2) Bifunktionaler PEG -Modifikator
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-CoOH, Mal-Peg-NHS
(3) Verzweigungsstiftmodifikator
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinisierung
Biotin kann stark mit Avidin oder Streptavidin gebunden werden, und die Bindungsfestigkeit ist sogar nahezu kovalenter Bindung. Biotin markierte Peptide werden üblicherweise in Immunoassay-, Histozytochemie- und Fluoreszenzbasis-Aufflusszytometrie verwendet. Markierte Antibiotin -Antikörper können auch zur Bindung biotinylierter Peptide verwendet werden. Biotin -Etiketten werden häufig an der Lysin -Seitenkette oder dem N -Terminal befestigt. 6-Aminocaprosäure wird häufig als Bindung zwischen Peptiden und Biotin verwendet. Die Bindung ist flexibel in der Bindung an das Substrat und bindet in Gegenwart einer sterischen Hinderung besser.
9. Fluoreszenzmarkierung
Fluoreszenzmarkierung kann verwendet werden, um Polypeptide in lebenden Zellen zu verfolgen und Enzyme und Wirkmechanismen zu untersuchen. Tryptophan (TRP) ist fluoreszierend und kann für die intrinsische Markierung verwendet werden. Das Emissionsspektrum von Tryptophan hängt von der peripheren Umgebung ab und nimmt mit abnehmender Lösungsmittelpolarität ab, einer Eigenschaft, die zum Nachweis der Peptidstruktur und der Rezeptorbindung nützlich ist. Die Tryptophan -Fluoreszenz kann durch protonierte Asparaginsäure und Glutaminsäure gelöscht werden, was ihre Verwendung einschränken kann. Die Dansylchloridgruppe (Dansyl) ist bei einer Aminogruppe stark fluoreszierend und wird häufig als fluoreszierendes Etikett für Aminosäuren oder Proteine verwendet.
Die Fluoreszenzresonanzenergieumwandlung (FRET) ist für Enzymstudien nützlich. Beim Anbringen von Bund enthält das Substratpolypeptid normalerweise eine Fluoreszenzmarkierungsgruppe und eine Fluoreszenz-Erleichterungsgruppe. Markierte fluoreszierende Gruppen werden vom Quencher durch Nicht-Photonen-Energieübertragung abgestoßen. Wenn das Peptid vom betreffenden Enzym dissoziiert wird, emittiert die Markierungsgruppe Fluoreszenz.
10. Käfigpolypeptide
Käfigpeptide haben optisch abnehmbare Schutzgruppen, die das Peptid vor der Bindung an den Rezeptor schützen. Bei UV -Strahlung wird das Peptid aktiviert, wodurch seine Affinität zum Rezeptor wiederhergestellt wird. Da diese optische Aktivierung nach Zeit, Amplitude oder Ort kontrolliert werden kann, können Käfigpeptide verwendet werden, um Reaktionen in Zellen zu untersuchen. Die am häufigsten verwendeten Schutzgruppen für Käfigpolypeptide sind 2-Nitrobenzylgruppen und deren Derivate, die in der Peptidsynthese über schützende Aminosäurerivate eingeführt werden können. Die entwickelten Aminosäurerivate sind Lysin, Cystein, Serin und Tyrosin. Aspartat- und Glutamatderivate werden jedoch aufgrund ihrer Anfälligkeit für die Cyclisierung während der Peptidsynthese und -Dissoziation nicht häufig verwendet.
11. Polyantigenes Peptid (Karte)
Kurze Peptide sind normalerweise nicht immun und müssen mit Trägerproteinen gekoppelt werden, um Antikörper zu produzieren. Polyantigenisches Peptid (MAP) besteht aus mehreren identischen Peptiden, die mit Lysinkern verbunden sind, was spezifisch hohe Potenzim Immunogene exprimieren kann und zur Herstellung von Proteinpeptid-Carrier-Proteinkoppletten verwendet werden kann. MAP -Polypeptide können durch feste Phasensynthese auf MAP -Harz synthetisiert werden. Eine unvollständige Kopplung führt jedoch zu fehlenden oder verkürzten Peptidketten in einigen Zweigen und zeigt daher nicht die Eigenschaften des ursprünglichen Kartenpolypeptids. Als Alternative können Peptide getrennt hergestellt und gereinigt werden und dann zur Karte gekoppelt werden. Die am Peptidkern gebundene Peptidsequenz ist gut definiert und leicht durch Massenspektrometrie charakterisiert.
Abschluss
Die Peptidmodifikation ist ein wichtiges Mittel zum Entwerfen von Peptiden. Chemisch modifizierte Peptide können nicht nur eine hohe biologische Aktivität aufrechterhalten, sondern auch effektiv die Nachteile von Immunogenität und Toxizität vermeiden. Gleichzeitig kann die chemische Modifikation Peptide mit einigen neuen hervorragenden Eigenschaften ausgeben. In den letzten Jahren wurde die Methode der C-H-Aktivierung zur Nachmodifizierung von Polypeptiden schnell entwickelt, und es wurden viele wichtige Ergebnisse erzielt.
Postzeit: 2025-07-03
