Die Phosphorylierung beeinflusst alle Aspekte des zellulären Lebens, und Proteinkinasen beeinflussen alle Aspekte der intrazellulären Kommunikationsfunktionen, indem sie Signalwege und zelluläre Prozesse regulieren. Eine aberrante Phosphorylierung ist jedoch auch die Ursache für viele Krankheiten; Insbesondere können mutierte Proteinkinasen und Phosphatasen viele Krankheiten verursachen, und viele natürliche Toxine und Krankheitserreger haben auch einen Effekt, indem sie den Phosphorylierungsstatus von intrazellulären Proteinen verändern.
Die Phosphorylierung von Serin (Ser), Threonin (Thr) und Tyrosin (Tyr) ist ein reversibler Proteinmodifikationsprozess. Sie sind an der Regulation vieler zellulärer Aktivitäten wie Rezeptorsignalisierung, Proteinassoziation und Segmentierung, Aktivierung oder Hemmung der Proteinfunktion und sogar des Überlebens von Zellen beteiligt. Phosphate werden negativ geladen (zwei negative Ladungen pro Phosphatgruppe). Daher verändert ihre Zugabe die Eigenschaften des Proteins, was normalerweise eine Konformationsänderung darstellt, was zu einer Änderung der Struktur des Proteins führt. Wenn die Phosphatgruppe entfernt wird, kehrt die Konformation des Proteins in ihren ursprünglichen Zustand zurück. Wenn die beiden Konformationsproteine unterschiedliche Aktivitäten aufweisen, könnte die Phosphorylierung als molekularer Schalter für das Protein wirken, um seine Aktivität zu kontrollieren.
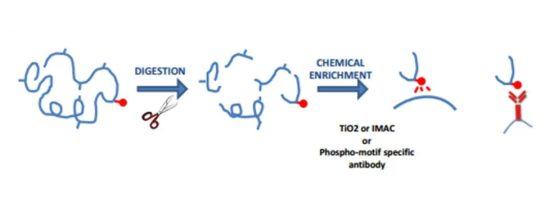
Viele Hormone regulieren die Aktivität spezifischer Enzyme durch Erhöhen des Phosphorylierungszustands von Serin- (Ser) oder Threonin (THR) -resten, und die Phosphorylierung von Tyrosin (Tyr) kann durch Wachstumsfaktoren (wie Insulin) ausgelöst werden. Die Phosphatgruppen dieser Aminosäuren können schnell entfernt werden. Somit fungiert Ser-, Thr- und Tyr -Funktionen als molekulare Schalter bei der Regulation zellulärer Aktivitäten wie der Tumorproliferation.
Synthetische Peptide spielen eine sehr nützliche Rolle bei der Untersuchung von Proteinkinase -Substraten und Wechselwirkungen. Es gibt jedoch einige Faktoren, die die Anpassungsfähigkeit der Phosphopeptid-Synthese-Technologie behindern oder begrenzen, z.
Die plattformbasierte Peptidsynthese und Phosphorylierungsmodifikationstechnologie überwindet diese Einschränkungen und verbessert und verbessert die Syntheseeffizienz und -Skalierbarkeit, und die Plattform eignet sich gut für die Untersuchung von Proteinkinase -Substraten, Antigenen, Bindungsmolekülen und Inhibitoren.
Postzeit: 2025-07-02
