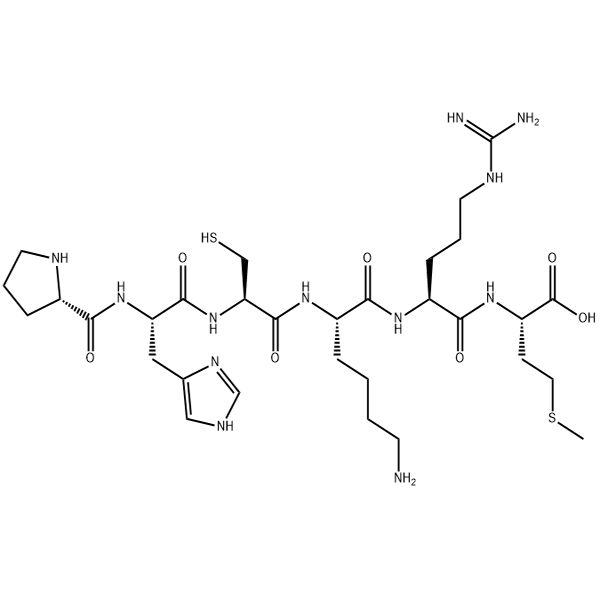
Amyloid β-Protein (4-42) Ammoniumsalz/157884-72-5/GT Peptid/Peptid-Lieferant
Beschreibung
B-Amyloid (4-42) ist ein Fragment von B-Amyloid -Protein. Die Reduktion der Sequenz verringert die Schwierigkeit der Synthese, und die Löslichkeit ist relativ besser. “B-Amyloid (4-42) unterscheidet sich nicht von anderen B-Amyloid in Bezug auf Speicherbedingungen und Halbwertszeit. “
Eine große Menge an B-Fold kann im Syntheseprozess von falsch positives Ninhydrin verursachen B-Amyloidprotein (4-42), die zu einer zu niedrigen Reinheit des Rohprodukts führen und die Reinigung und Trennung im späteren Stadium beeinflussen können. Zweitens die extrem starke Hydrophobizität von B-Amyloid (4-42) führt zu Schwierigkeiten in der Auflösung, die die experimentellen Details während des Erzeugungsprozesses erfassen müssen.
Spezifikationen
APRERANCE: Weiß bis nicht weißes Pulver
Reinheit (HPLC): ≥98.0%
Einzelverunreinigung: ≤2.0%
Acetatgehalt (HPLC): 5,0%~12.0%
Wassergehalt (Karl Fischer): ≤10.0%
Peptidgehalt: ≥80.0%
Verpackung und Versand: niedrige Temperatur, Vakuumverpackung, genau auf MG nach Bedarf.
Wie bestellt ich?
1. Kontaktieren Sie uns direkt per Telefon oder E-Mail: +86-13735575465, sales1@gotopbio.com.
2. Online bestellen. Bitte füllen Sie das Online -Bestellformular aus.
3. Geben Sie bei Bedarf einen Peptidnamen, CAS -Nr. Oder Sequenz, Reinheit und Modifikation an, usw. Wir geben ein Angebot innerhalb von 2 Stunden an.
V.
5. Wir werden den Auftragsfortschritt kontinuierlich rechtzeitig aktualisieren.
6. Peptidabgabe durch DHL, FedEx oder andere und HPLC, MS, COA werden zusammen mit der Fracht bereitgestellt.
7. Die Rückerstattungsrichtlinie wird befolgt, wenn unsere Qualität oder unseren Dienst eine Diskrepanz.
8. After-Sale-Service: Wenn unsere Kunden während des Experiments Fragen zu unserem Peptid haben, können Sie uns gerne kontaktieren, und wir werden in kurzer Zeit darauf antworten.
Alle Produkte des Unternehmens werden nur für wissenschaftliche Forschungszwecke verwendet.’s verboten, direkt von Personen am menschlichen Körper verwendet zu werden.
FAQ:
Wurden die Peptide, die Cys enthielten, vor dem Versand reduziert?
Wenn nicht festgestellt wird, dass das Peptid oxidiert wurde, reduzieren wir im Allgemeinen keine Cys. Alle Polypeptide werden aus rohen Produkten erhalten, die unter pH2 -Bedingungen gereinigt und lyophilisiert wurden, was zumindest in gewissem Maße die Oxidation von Cys verhindern. Peptide, die Cys enthalten, werden bei PH2 gereinigt, es sei denn, es gibt einen spezifischen Grund, bei pH6.8 zu reinigen. Wenn die Reinigung bei pH6.8 durchgeführt wird, muss das gereinigte Produkt sofort mit Säure behandelt werden, um die Oxidation zu verhindern. Im endgültigen Qualitätskontrollschritt wird für die Peptide, die Cys enthalten, wenn das Vorhandensein von Molekulargewicht (2p+H) auf der MS -Karte gefunden wird, angezeigt, dass ein Dimer gebildet wurde. Wenn es kein Problem mit MS und HPLC gibt, werden wir die Ware direkt ohne weitere Bearbeitung lyophilisieren und versenden. Es ist zu beachten, dass Peptide, die Cys enthalten, im Laufe der Zeit langsam oxidieren, und der Oxidationsgrad hängt von der Peptidsequenz und den Speicherbedingungen ab.
Wie bestimmen Sie, ob ein Peptid geschoben wird?
Wir verwenden die Ellman -Reaktion, um zu testen, ob die Ringbildung vollständig ist. Wenn der Ellman -Test positiv (gelb) ist, ist die Ringreaktion unvollständig. Wenn die Testergebnisse negativ sind (nicht gelb), war die Ringreaktion vollständig. Wir bieten keinen Analysebericht über die Identifizierung von Cyclisierung für unsere Kunden. Im Allgemeinen wird die Testergebnisse von Ellman im QC -Bericht beschrieben.
Ich brauche ein zyklisches Peptid, das ein Tryptophan enthält. Wird es oxidiert?
Die Oxidation von Tryptophan ist ein gemeinsames Phänomen bei der Peptidoxidation, und Peptide werden normalerweise vor der Reinigung zyklisiert. Wenn die Oxidation von Tryptophan auftritt, ändert sich die Retentionszeit des Peptids an der HPLC -Säule und die Oxidation kann durch Reinigung entfernt werden. Darüber hinaus können oxidierte Peptide auch durch MS nachgewiesen werden.
Ist es notwendig, eine Lücke zwischen dem Peptid und dem Farbstoff zu stellen?
Wenn Sie ein großes Molekül (z. B. einen Farbstoff) an das Peptid anbringen möchten, ist es am besten, einen Raum zwischen dem Peptid und dem Liganden zu legen, um die Interferenz mit dem Rezeptor durch Faltung des Peptids selbst oder durch Faltung seines Konjugats zu minimieren. Andere wollen keine Intervalle. Zum Beispiel ist bei der Faltung von Proteinen möglich, wie weit die Faltstruktur einer Aminosäure voneinander entfernt ist, indem ein fluoreszierender Farbstoff an einer bestimmten Stelle angebracht wird.
Wenn Sie am N -Terminal eine Biotinmodifikation vornehmen möchten, müssen Sie dann eine Lücke zwischen dem Biotin und der Peptidsequenz einstellen?
Das von unserem Unternehmen verwendete Standard -Biotin -Kennzeichnungsverfahren besteht darin, eine AHX an der Peptidkette zu befestigen, gefolgt von Biotin. AHX ist eine 6-Kohlenstoff-Verbindung, die als Barriere zwischen dem Peptid und dem Biotin wirkt.
Können Sie einige Ratschläge zum Design phosphorylierter Peptide geben?
Mit zunehmender Länge nimmt die Bindungseffizienz immer wieder von der phosphorylierten Aminosäure ab. Die Syntheserichtung ist vom C -Terminal zum N -Terminal. Es wird empfohlen, dass die Reste nach der phosphorylierten Aminosäure 10 nicht überschreiten sollten, dh die Anzahl der Aminosäurereste vor der phosphorylierten Aminosäure vom N -Terminal zum C -Anschluss sollte 10 nicht überschreiten.
Warum die N-terminale Acetylierung und C-terminale Amidierung?
Diese Modifikationen verhindern, dass das Peptid abgebaut wird, und ermöglicht es dem Peptid, seinen ursprünglichen Zustand der Alpha -Amino- und Carboxylgruppen im Elternprotein nachzuahmen.