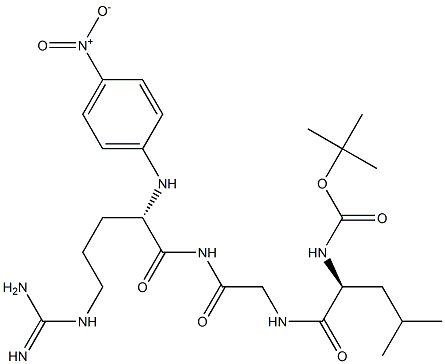
Das Limulus-Reagenz-Tripeptid ist eine Tripeptidsubstanz mit einer spezifischen Sequenz, die aus Lysat von Pfeilschwanzkrebs-Blutzellen extrahiert oder künstlich synthetisiert wird. Das Limulus-Reagenz-Tripeptid ist ein chromogenes Substrat, das für quantitative Analysen (z. B. den bakteriellen Endotoxintest) zum Nachweis und zur Messung der Bestandteile gramnegativer Bakterien verwendet wird—Endotoxine. Bei Einwirkung von Enzymen, die durch Endotoxine aktiviert werden, wird eine farbige Verbindung (z. B. p-Nitroanilin) freigesetzt, wodurch die Farbintensität gemessen und mit dem Endotoxingehalt korreliert werden kann.
Funktionsprinzip
Endotoxin-Aktivierung: In Gegenwart von Endotoxinen setzen Amöbozyten im Blut von Pfeilschwanzkrebsen Enzyme frei und lösen dadurch die Gerinnungskaskade aus.
Enzymwirkung: Das aktivierte Enzym (normalerweise Gerinnungsenzym) wirkt dann auf ein chromogenes Substrat.
Chromogene Reaktion: Das Enzym spaltet das Substrat und setzt eine gelbe Verbindung namens p-Nitroanilin (pNA) frei.
Quantitative Analyse: Die Intensität der gelben Farbe ist proportional zum Endotoxingehalt in der Probe und wird normalerweise mit einem Spektrophotometer bei einer Absorption von 405 nm gemessen.
Vorbereitungsmethoden
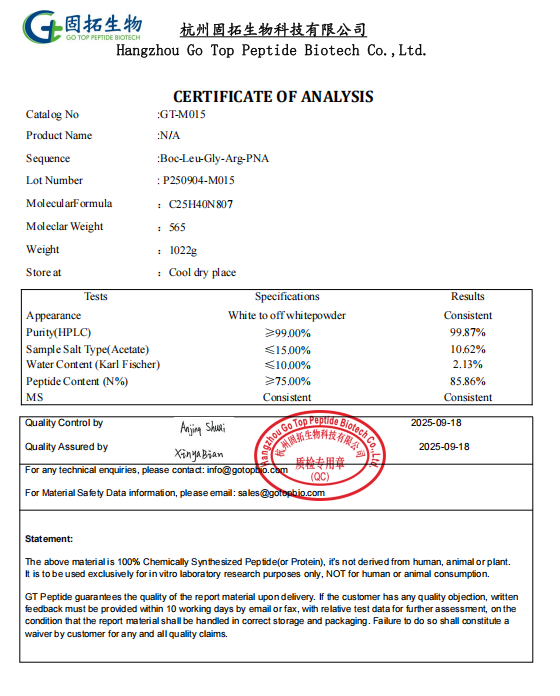
Das Limulus-Reagenz-Tripeptid kann hinsichtlich der Herstellung auf zwei Wegen gewonnen werden.
1. Extraktion natürlicher Bestandteile aus Limulus-Blutzellen und Gewinnung des aktiven Tripeptids durch Trennung und Reinigung.
2. Einsatz der Festphasensynthesetechnologie zur sequentiellen Verbindung spezifischer Aminosäuresequenzen, wodurch die Struktur des Tripeptids präzise gesteuert wird.
Aufgrund der Naturschutzrichtlinien für Limulus (Provinzen wie Zhejiang, Fujian, Guangdong und Guangxi führen es als „wichtigste geschützte Wassertierwelt der Provinz“ / Hongkong erließ Ende 2012 Vorschriften zum Verbot der Grundschleppnetzfischerei) und weil der Gewinnungsprozess komplex und herausfordernd ist, sind die Kosten für die erste Methode relativ hoch. Daher wird heute häufig die Festphasensynthese eingesetzt. Durch die sequentielle Verknüpfung spezifischer Aminosäuresequenzen kann die Struktur des Tripeptids präzise gesteuert werden. Diese Methode gewährleistet nicht nur die Stabilität und Konsistenz des Produkts, sondern ermöglicht auch eine Produktion in großem Maßstab und erfüllt damit den Bedarf der Pharmaindustrie an Testreagenzien.
Zeitpunkt der Veröffentlichung: 04.11.2025
