Entsprechend der Verbindungsart von Aminosäure und Zucker können Zuckerpeptide in vier Kategorien eingeteilt werden: O-Glykosylierung, C- und N-Glykosylierung, Tauverzuckerung und GPI-Verbindung (Glycophosphatidlyinositol).
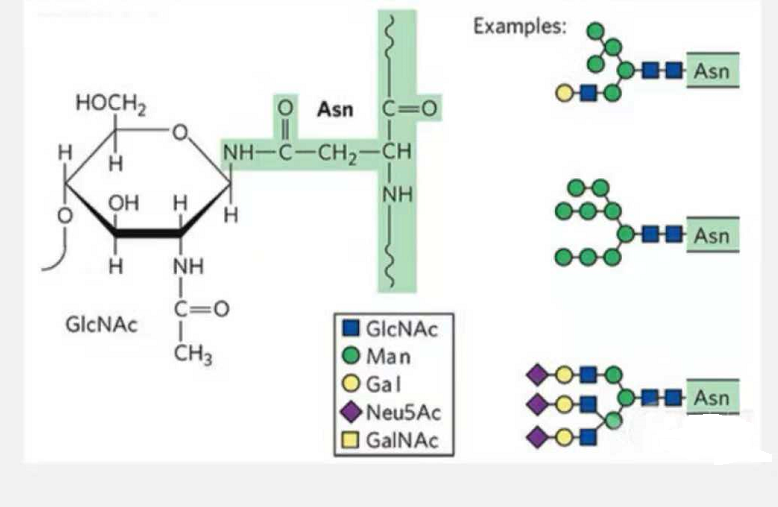
1. N-Glykosylierungs-Glykopeptide bestehen aus N-Acetamidglukose am reduzierenden Ende der Glykankette (Glc-Nac), verbunden mit dem N-Atom an der Amidgruppe der Seitenkette von etwas Asn in der Peptidkette, und dem Asn Moleküle, die in der Lage sind, die Glykankette zu verknüpfen, müssen sich im AsN-X-Ser/Thr (X! =P) des durch die Reste gebildeten Motivs befinden.Der Zucker ist N-Acetylglucosamin.
Durch N-Glykosylierung modifiziertes strukturelles Glykopeptid
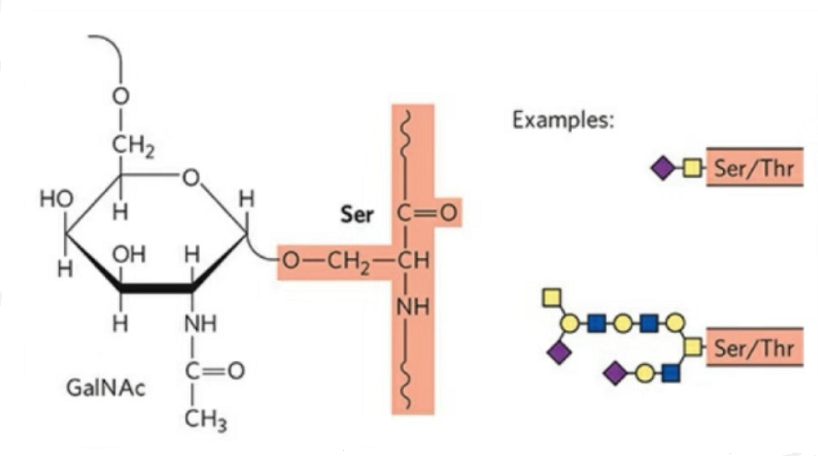
2. Die Struktur der O-Glykosylierung ist einfacher als die der N-Glykosylierung.Dieses Glykopeptid ist im Allgemeinen kürzer als das Glykan, weist jedoch mehr Typen als die N-Glykosylierung auf.Ser und Thr können im Allgemeinen in der Peptidkette glykosyliert sein.Darüber hinaus gibt es Glykopeptide, die mit Tyrosin-, Hydroxyl- und Hydroxyprolin-Glykosylierung versehen sind.Die Verknüpfungsposition ist das Hydroxyl-Sauerstoffatom an der Seitenkette des Rests.Die verknüpften Zucker sind Galactose oder N-Acetylgalactosamin (Gal&GalNAc) oder Glucose/Glucosamin (Glc/GlcNAc), Mannose/Mannosamin (Man/ManNAc) usw.
Durch O-Glykosylierung wird die Struktur verändert
3. Glykopeptid-O-GlcNAC-Glykosylierung ((N-Acetylcystein (NAC)) (glcnAcN-Acetylglucosamin/Acetylglucosamin)
Eine einzelne N-Acetylglucosamin (GlcNAc)-Glykosylierung verbindet das O-GlcNAc des Proteins mit dem Hydroxylsauerstoffatom des Serin- oder Threoninrests eines Proteins.Die O-GlcNA-Glykosylierung ist eine O-GlcNAc-Monosaccharidverzierung ohne Glykanverlängerung;Wie die Peptidphosphorylierung ist auch die O-GlcNAc-Glykosylierung von Glykopeptiden ein dynamischer Proteindekorationsprozess.Eine abnormale O-GlcNAc-Dekoration kann eine Vielzahl von Krankheiten wie Diabetes, Herz-Kreislauf-Erkrankungen, Tumoren, Alzheimer-Krankheit usw. verursachen.
Glykosylierungspunkte von Glykopeptiden
Die Grundstrukturen von Polypeptid- und Zuckerketten sind durch kovalente Bindungen mit Proteinketten verbunden, und die Stellen, die die Zuckerketten verbinden, werden Glykosylierungsstellen genannt.Da es keine Vorlage gibt, um die Biosynthese von Glycopeptid-Zuckerketten zu verfolgen, werden verschiedene Zuckerketten an dieselbe Glykosylierungsstelle gebunden, was zur sogenannten mikroskopischen Inhomogenität führt.
Glykosylierung von Glykopeptiden
1. Einfluss der Glykopeptid-Glykosylierung auf die Therapiewirksamkeit therapeutischer Proteine
Bei therapietherapeutischen Proteinen beeinflusst die Glykosylierung auch die Halbwertszeit und das Targeting von Proteinarzneimitteln in vivo
2. Glykosylierung löslicher Glykopeptide und Proteine
Studien haben gezeigt, dass Zuckerketten auf der Oberfläche von Proteinen die molekulare Löslichkeit von Proteinen verbessern können
3. Glykopeptidglykosylierung und Proteinimmunogenität
Einerseits können Zuckerketten auf der Oberfläche von Proteinen spezifische Immunreaktionen auslösen.Andererseits können Zuckerketten bestimmte Oberflächen der Proteinoberfläche bedecken und deren Immunogenität verringern
4. Glykopeptid-Glykosylierung, die die Proteinstabilität erhöht
Die Glykosylierung kann die Stabilität von Proteinen gegenüber verschiedenen Denaturierungsbedingungen (wie Denaturierungsmittel, Hitze usw.) erhöhen und die Aggregation von Proteinen verhindern.Gleichzeitig können die Zuckerketten auf der Oberfläche von Proteinen auch einige proteolytische Abbaustellen von Proteinmolekülen abdecken und so die Widerstandsfähigkeit von Proteinen gegenüber Proteinasen erhöhen
5. Glykopeptid-Glykosylierung, die die biologische Aktivität von Proteinmolekülen beeinflusst
Durch eine Veränderung der Proteinglykosylierung können Proteinmoleküle auch dazu befähigt werden, neue biologische Aktivitäten auszubilden
Zeitpunkt der Veröffentlichung: 03.08.2023